众所周知,企业上报医疗器械优先审批,如收到药监部门出具的批准通知,就会享有到监管审批部门“早期介入、专人负责、科学审批”的政策支持,这是在创新医疗器械注册申报后,有生产特殊治疗效果的医疗器械企业的福利。过程中会增多专家在研发环节交流沟通的机会,可以说是利益巨大。
医疗器械优先审批对象
境内二类(所在地省药监局)和三类(国家药监局);境外二三类医疗器械(国家药监局)。
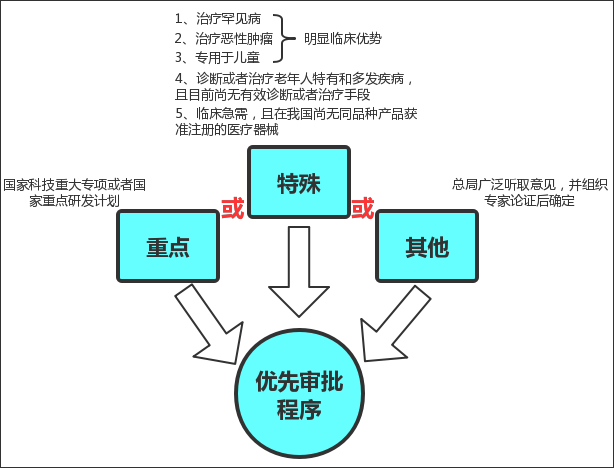
符合下列情形之一的医疗器械可以纳入优先审批程序(附图)
1、诊断或者治疗罕见病,且具有明显临床优势;
2、诊断或者治疗恶性肿瘤,且具有明显临床优势;
3、诊断或者治疗老年人特有和多发疾病,且目前尚无有效诊断或者治疗手段;
4、专用于儿童,且具有明显临床优势;
5、临床急需,且在我国尚无同品种产品获准注册的医疗器械。
另外,列入国家科技重大专项或者国家重点研发计划的医疗器械,以及其他应当优先审批的医疗器械也可纳入优先审批程序。
优先审批程序提交材料
1、医疗器械优先审批申请表;
2、注册申报资料(12项资料);
3、该产品列入国家科技重大专项或者国家重点研发计划的相关证明文件(仅针对国家专项和重点)。
三类医疗器械优先审批流程
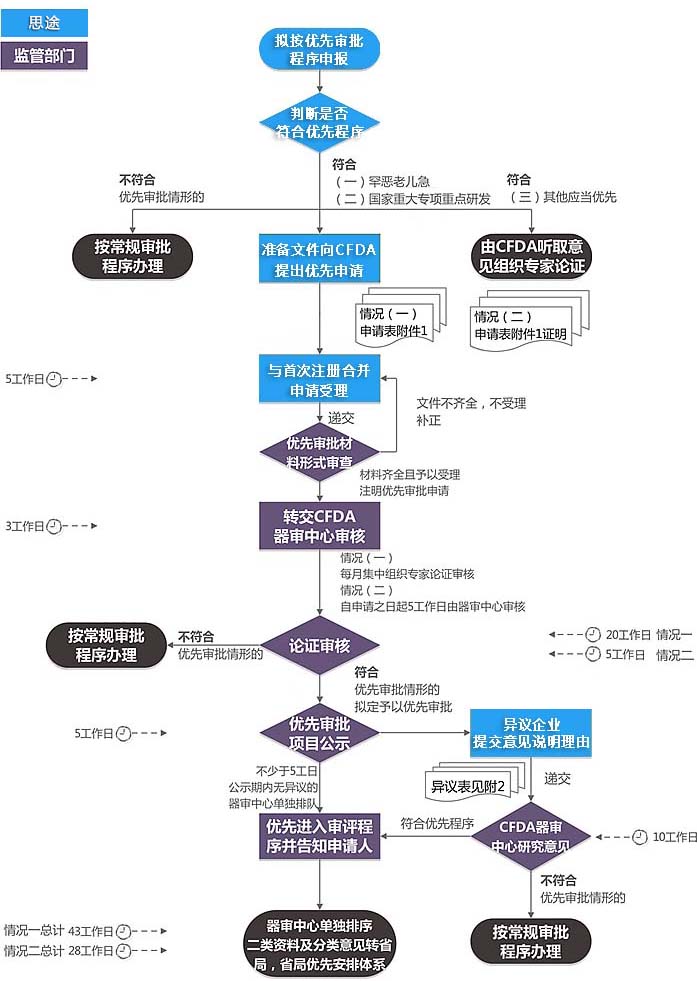
1、药监总局医疗器械注册申请受理部门对优先审批申请材料进行形式审查,对优先审批申请材料齐全且予以受理的注册申请项目,注明优先审批申请,转交总局器审中心进行审核。
2、对于优先快速审批程序第二条第(一)项情形的医疗器械优先审批申请以及其他应当优先审批的医疗器械,器审中心每月集中组织专家论证审核,出具审核意见。经专家论证需要优先审批的,拟定予以优先审批。
3、器审中心经审核不予优先审批的,将不予优先审批的意见和原因告知申请人,并按常规审批程序办理。
医疗器械优先审批程序服务流程
医疗器械优先审批程序收费标准
办理医疗器械优先审批,官方不收费。优先审批不影响相对应省份的官方收费情况。
医疗器械优先审批程序办理依据
| 文件名 | 文号 |
|---|
| 总局关于发布医疗器械优先审批程序的公告 | 局令16年168号 |
| 《医疗器械监督管理条例》 | 650号文件 |
医疗器械优先审批程序服务周期
预计时间
按医疗器械优先审批程序服务流程图所示:
情况一总计43工作日,进入正式进入单独排序的优先审评环节。
情况二总计28工作日,进入正式进入单独排序的优先审评环节。
如未提出异议,最快18工作日,进入正式进入单独排序的优先审评环节。
优先审批
CFDA器械审评中心对列入优先审批的医疗器械注册申请,按照接收时间单独排序,优先进行技术审评。
省级药监管理部门优先安排医疗器械注册质量管理体系核查。
医疗器械优先审批程序推荐服务



