在我国,第二类体外诊断试剂实行注册管理。而当企业注册人名称、住所、生产地址改变时,应当做注册证登记事项变更申请。
第二类体外诊断试剂注册证登记事项变更办理条件
1、第二类医疗器械注册证(体外诊断试剂)及其附件载明的内容发生变化。
2、申请登记事项变更包括:注册人名称、住所变更、生产地址变更。注册人名称和住所发生变化的,注册人应当向原注册部门申请登记事项变更,境内体外诊断试剂生产地址变更的,注册人应当在相应的生产许可变更后办理注册登记事项变更。
3、申请应符合《体外诊断试剂注册与备案管理办法》的要求。
第二类体外诊断试剂注册证变更(登记事项变更)申请材料
(一)申请表;
(二)证明性文件(境内注册人提供):企业营业执照副本复印件和组织机构代码证复印件。
(三)注册人关于变更情况的声明;
(四)原医疗器械注册证及其附件复印件、历次医疗器械注册变更文件复印件;
(五)关于变更情况相关的申报资料要求;
1、注册人名称变更:相应详细变更情况说明及相应证明文件。
2、注册人住所变更:相应详细变更情况说明及相应证明文件。
3、境内体外诊断试剂生产地址变更:应当提供相应变更后的生产许可证复印件。
(六)符合性声明
1、注册人声明本产品符合《体外诊断试剂注册与备案管理办法》和相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单。
2、注册人出具所提交资料真实性的自我保证声明。
第二类IVD注册证(登记事项)变更服务流程
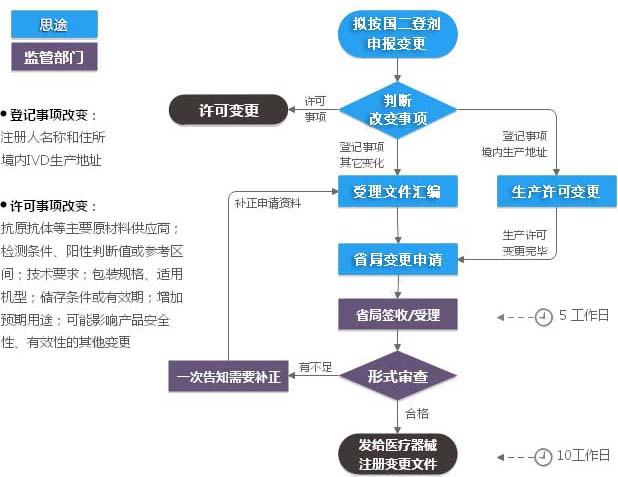
第二类IVD注册证变更(登记事项变更)收费标准
办理二类IVD注册证登记事项变更,官方不收取变更申请费用。
第二类IVD注册证变更(登记事项变更)办理依据
| 文件名称 | 文号 |
|---|
| 《医疗器械监督管理条例》 | 650号文件 |
| 《体外诊断试剂注册与备案管理办法》 | 市场监督管理总局令第48号 |
第二类IVD注册证变更(登记事项变更)服务周期
立项阶段
预算、合同、考虑期,3个工作日。
受理前资料准备
资料收集、申报资料撰写,预计10个工作日。
资料确认、盖章需5个工作日。
申请后
登记事项变更法规时间15个工作日,加等待时间,至少需1个月。
预算合计
立项后,到登记事项变更完成约1-2个月。
第二类IVD注册证变更(登记事项变更)相关服务


